Uma nova perspectiva no tratamento da cegueira
Théo Vasconcellos, Marília Móvio, Giulia Ribeiro e Alexandre Kihara
Laboratório de Neurogenética / Centro de Matemática, Computação e Cognição / Universidade Federal do ABC
Texto originalmente postado em 2019 na NANOCELL NEWS
O olho é um órgão delicado e complexo composto por diversas estruturas que, juntas, permitem a formação da imagem. Dentre essas estruturas, destaca-se a retina, tecido pertencente ao sistema nervoso central (SNC) com células altamente especializadas para efetuar a fototransdução, processo pelo qual estímulos que provém da luz são transformados em sinal eletroquímico, que serão posteriormente interpretado no encéfalo (Hildebrand & Fielder, 2011; Miesfeld & Brown, 2019).
A retina, quando completamente desenvolvida, é composta por cinco diferentes camadas que possuem diversos tipos de células. Essas são responsáveis por executar funções específicas do processamento visual, auxiliando desde a conversão do sinal luminoso, até a entrega da informação às áreas superiores (Fig.1) (Hildebrand & Fielder, 2011; Miesfeld & Brown, 2019).
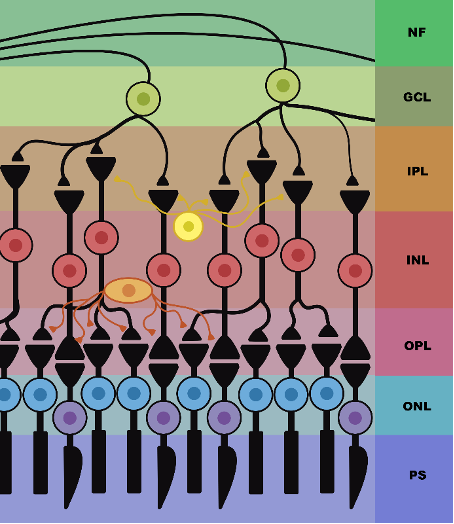
Dentre essas camadas, destaca-se a camada nuclear externa (ONL), composta pelos núcleos das células fotorreceptoras, que são as células fotossensíveis da retina. Essas células são capazes de responder à presença de luz e sua especialidade é converter o estímulo que chega ao olho em sinal eletroquímico, levando ao encéfalo um impulso nervoso diferente para cada intensidade e qualidade de luz, permitindo que as diferentes imagens sejam reconhecidas (Hildebrand & R. Fielder, 2011; Miesfeld & Brown, 2019).
Os fotorreceptores são divididos em dois subtipos celulares: os cones e bastonetes. Os cones, presentes na parte mais central da retina, são as células responsáveis pela qualidade visual e percepção de cores. Em humanos, há presença de três tipos de cones diferentes que identificam majoritariamente comprimentos de ondas distintos, ou seja, cores diferentes. Já os bastonetes, presentes nas regiões mais periféricas da retina, são as células responsáveis pelo delineamento de forma e no auxílio na visão noturna, já que reagem à pouca quantidade de luz e não participam do processo de percepção de cor (Barbur & Stockman, 2010).
A retina humana tem aproximadamente 5 milhões de cones na retina, enquanto os bastonetes chegam ao número de 107 milhões (Hildebrand & Fielder, 2011). Por serem células sensíveis à luz e importantes no processo da visão, qualquer desequilíbrio ou mal funcionamento desses conjuntos de células pode resultar em doenças visuais (Hildebrand & Fielder, 2011). Quando ocorre um desbalanço ou disfunção progressiva em ambos cones e bastonetes, o paciente pode desenvolver uma doença progressiva conhecida como retinose pigmentar (RP), que eventualmente causa perda de visão total ou parcial (Verbakel et al., 2018).
A RP é uma doença hereditária rara causada por mutações nos genes de codificação de proteínas envolvidas na manutenção e função das células fotorreceptoras (Hamel, 2006; Verbakel et al., 2018). Estima-se que, mundialmente, essa doença tenha uma incidência de 1 para 3000-5000 habitantes, com cerca de dois milhões de pessoas afetadas pelo mundo (Chizzolini et al., 2011).
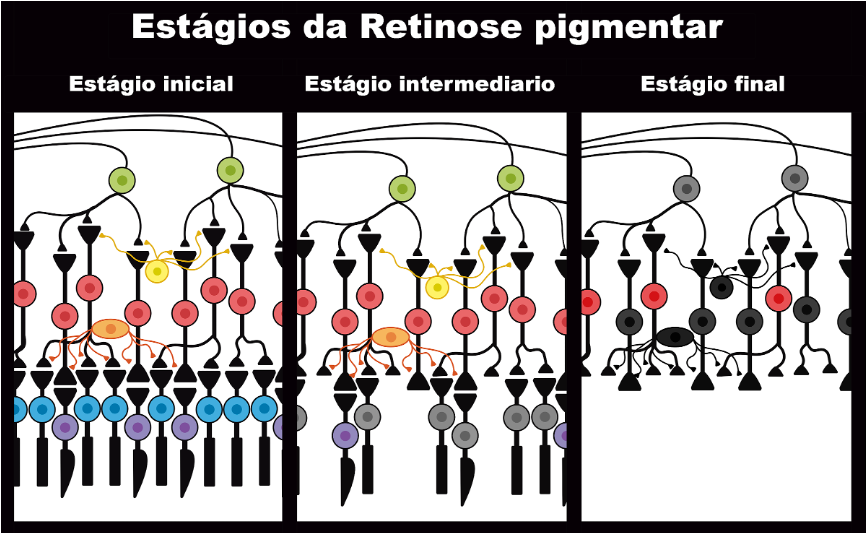
Essa doença afeta especificamente os bastonetes, levando-os a sofrer morte celular por apoptose decorrente de mutações genéticas em enzimas específicas e, por consequência, afeta as demais células deste sistema, ocasionando uma morte celular secundária sobretudo entre cones. A doença pode progredir em décadas, sendo dividida em três estágios, ocorrendo durante os primeiros anos de vida do indivíduo (Ali, Rahman, Cao, & Yuan, 2017; Campochiaro & Mir, 2018; Verbakel et al., 2018).
O estágio inicial é definido principalmente pela perda gradual da visão noturna, com pouco prejuízo da visão diurna e qualidade visual. O progresso da doença leva ao estágio intermediário, no qual a cegueira noturna torna-se evidente, além da redução da visão periférica e qualidade visual. Atividades cotidianas como dirigir, ler e conhecer lugares novos começam a se tornar mais difíceis, pois neste estágio os sintomas são bem mais evidentes. No estágio final da doença, o portador já não possui visão periférica e apresenta fotofobia intensa, ou seja, não suporta ambientes claros ou luz forte, progredindo até total perda da visão (Fig. 2) (Hamel, 2006).
Embora a RP seja uma doença bastante estudada com estágios de desenvolvimento bem demarcados e com consenso entre os pesquisadores de que mutações gênicas são a causa primária da morte dos fotorreceptores, ainda é incerto o que causa a progressão dessa degeneração, levando a uma distrofia de cones e bastonetes. Uma das propostas recentes é que essa progressão se dê por um fenômeno conhecido por estresse oxidativo (SO) (Piano, D’Antongiovanni, Testai, Calderone, & Gargini, 2019).
O SO é caracterizado pela presença de moléculas reativas, também chamados de radicais livres ou espécies reativas de oxigênio (ERO), que possuem um elétron desemparelhado. Em estado fisiológico, a célula possui diversas maneiras de equilibrar as EROs, como a produção de enzimas antioxidantes e proteínas que atuam contra o SO (Simonian & Coyle, 1996; Storz & Imlay, 1999; Uttara, Singh, Zamboni, & Mahajan, 2009).Entretanto, uma vez que há um alto nível de oxigênio na célula ou há geração de ERO em excesso, o sistema antioxidante da célula pode não ser suficiente para a diminuição dessas moléculas. O acúmulo de ERO é prejudicial ao meio, podendo danificar proteínas e lipídeos que compõem a membrana celular e até mesmo o DNA (Simonian & Coyle, 1996).
Relacionando com a RP, sabe-se que em estado fisiológico os fotorreceptores são células que possuem alta taxa metabólica, com um consumo elevado de oxigênio (Hildebrand & R. Fielder, 2011).Quando ocorre a morte inicial dos bastonetes, o oxigênio passa a não ser utilizado, e o acúmulo de oxigênio leva a um SO que, posteriormente, leva a morte dos outros fotorreceptores (Komeima, Rogers, Lu, & Campochiaro, 2006). Essa hipótese de que a morte posterior de cones na RP é causada por estresse oxidativo já foi demonstrada por diversos autores (Esterbauer, Schaur, & Zollner, 1991; Komeima et al., 2006; Shen et al., 2005).
A partir dessa hipótese, começou-se a supor que tratamentos locais ou sistêmicos com substâncias antioxidantes, como os flavonóides, podem retardar a morte secundária da RP, com o objetivo de realizar manutenção para retardar a perda da visão (Komeima et al., 2006). De fato, os resultados recentes com essa proposta de tratamento em modelo animal têm se mostrado bastante promissora (Head, 1999; Miranda et al., 2010; Tremblay, Waterhouse, Nason, & Kalt, 2013).
Flavonóides são moléculas bioativas encontradas naturalmente em frutas, vegetais, nozes, sementes, chás e até mesmo no vinho (Cook & Samman, 1996). Essas possuem um amplo leque de efeitos biológicos, incluindo anti bactericida, antiviral, anti-inflamatório, antialérgico, anti-oxidante. Além disso, diversos pesquisadores propuseram que os flavonóides podem ter ação neuroprotetora e neuro-restaurativa (Ayaz et al., 2019; Cook & Samman, 1996; Zhao et al., 2019).
Essas mesmas substâncias vêm recebendo grande destaque em estudos de diversas patologias como doenças cardiovasculares (Grosso et al., 2017; Maaliki, Shaito, Pintus, El-Yazbi, & Eid, 2019), diabetes (Bai et al., 2019; Liu et al., 2014), câncer (Abotaleb et al., 2018; Russo & Ungaro, 2019), obesidade (Ballard & Maróstica, 2019; Varshney, Mishra, Das, Sircar, & Roy, 2019) e doenças neurodegenerativas (Zhao et al., 2019).
Em um estudo publicado em maio de 2019, foi demonstrado que o consumo dos flavonóides quercetina e naringenina por roedores geneticamente modificados que possuem RP, pode reduzir significantemente a quantidade de ERO na ONL, mantendo alguns cones ainda morfologicamente saudáveis mesmo após a distrofia dos bastonetes (Fig. 3) (Piano, D’Antongiovanni, Testai, Calderone, & Gargini, 2019). Neste estudo, os roedores receberam doses dessas moléculas diluídas em sua água por 27 dias e, como resultado. foi observado maior preservação da ONL em relação ao grupo controle, sendo que a camada dos segmentos dos fotorreceptores ainda vivos apresentavam sua morfologia normal. Entretanto, experimentos com o objetivo de testar a funcionalidade dessas células em resposta à luz tiveram resultados que não se diferiram do grupo que não recebeu o tratamento, isso significa que esses cones não funcionam em sua totalidade, sendo que não possuem a eficiência de um cone de retina saudável.
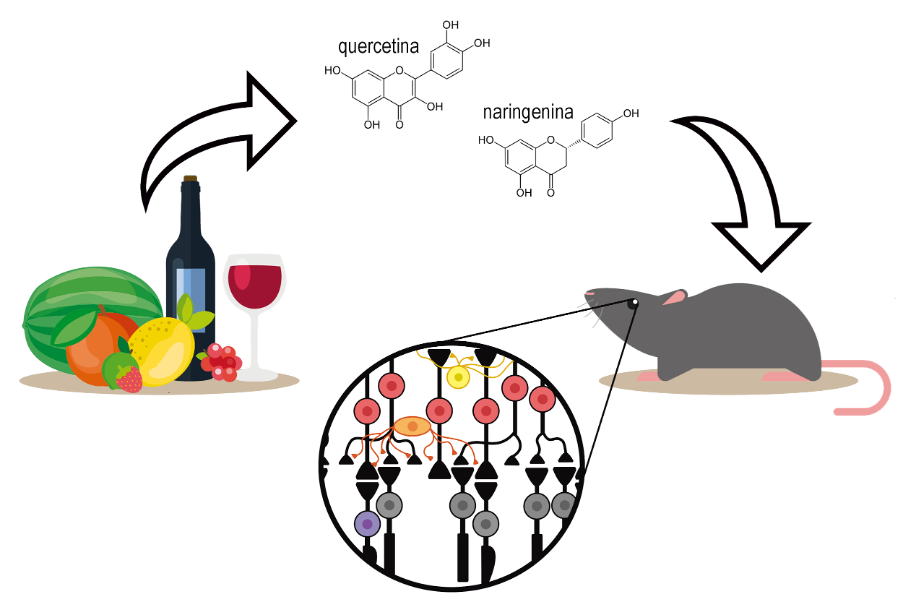
Assim, os resultados do estudo confirmam a hipótese de que a morte dos cones tem como estresse oxidativo o ponto crucial no processo de morte celular na doença de RP. Além disso, o estudo demonstrou os benefícios dos efeitos antioxidantes das moléculas flavonóides sobre a degeneração dos cones após distrofia dos bastonetes, conseguindo limitar a neurodegeneração na retina de camundongos portadores dessa doença. Embora essa ideia de tratamento parece ser eficaz em roedores, estudos ainda precisam ser realizados para que seja verificado o efeito dos flavonóides em humanos com RP.
Referências
Abotaleb, M., Samuel, S. M., Varghese, E., Varghese, S., Kubatka, P., Liskova, A., & Busselberg, D. (2018). Flavonoids in Cancer and Apoptosis. Cancers (Basel), 11(1). doi:10.3390/cancers11010028
Ali, M. U., Rahman, M. S. U., Cao, J., & Yuan, P. X. (2017). Genetic characterization and disease mechanism of retinitis pigmentosa; current scenario. 3 Biotech, 7(4), 251. doi:10.1007/s13205-017-0878-3
Ayaz, M., Sadiq, A., Junaid, M., Ullah, F., Ovais, M., Ullah, I., Shahid, M. (2019). Flavonoids as Prospective Neuroprotectants and Their Therapeutic Propensity in Aging Associated Neurological Disorders. Front Aging Neurosci, 11, 155. doi:10.3389/fnagi.2019.00155
Bai, L., Li, X., He, L., Zheng, Y., Lu, H., Li, J., Li, J. (2019). Antidiabetic Potential of Flavonoids from Traditional Chinese Medicine: A Review. Am J Chin Med, 1-25. doi:10.1142/S0192415X19500496
Ballard, C. R., & Maróstica, M. R. (2019). Chapter 10 – Health Benefits of Flavonoids. In M. R. S. Campos (Ed.), Bioactive Compounds (pp. 185-201): Woodhead Publishing.
Barbur, J., & Stockman, A. (2010). Photopic, Mesopic and Scotopic Vision and Changes in Visual Performance. In (pp. 323-331).
Campochiaro, P. A., & Mir, T. A. (2018). The mechanism of cone cell death in Retinitis Pigmentosa. Prog Retin Eye Res, 62, 24-37. doi:10.1016/j.preteyeres.2017.08.004
Chizzolini, M., Galan, A., Milan, E., Sebastiani, A., Costagliola, C., & Parmeggiani, F. (2011). Good epidemiologic practice in retinitis pigmentosa: from phenotyping to biobanking. Curr Genomics, 12(4), 260-266. doi:10.2174/138920211795860071
Cook, N. C., & Samman, S. (1996). Flavonoids—Chemistry, metabolism, cardioprotective effects, and dietary sources. The Journal of Nutritional Biochemistry, 7(2), 66-76. doi:https://doi.org/10.1016/S0955-2863(95)00168-9
Esterbauer, H., Schaur, R. J., & Zollner, H. (1991). Chemistry and biochemistry of 4-hydroxynonenal, malonaldehyde and related aldehydes. Free Radic Biol Med, 11(1), 81-128.
Grosso, G., Micek, A., Godos, J., Pajak, A., Sciacca, S., Galvano, F., & Giovannucci, E. L. (2017). Dietary Flavonoid and Lignan Intake and Mortality in Prospective Cohort Studies: Systematic Review and Dose-Response Meta-Analysis. Am J Epidemiol, 185(12), 1304-1316. doi:10.1093/aje/kww207
Hamel, C. (2006). Retinitis pigmentosa. Orphanet J Rare Dis, 1, 40. doi:10.1186/1750-1172-1-40
Head, K. A. (1999). Natural therapies for ocular disorders, part one: diseases of the retina. Altern Med Rev, 4(5), 342-359.
Hildebrand, G. D., & Fielder, A. R. (2011). Anatomy and Physiology of the Retina. In J. Reynolds & S. Olitsky (Eds.), Pediatric Retina (pp. 39-65). Berlin, Heidelberg: Springer Berlin Heidelberg.
Komeima, K., Rogers, B. S., Lu, L., & Campochiaro, P. A. (2006). Antioxidants reduce cone cell death in a model of retinitis pigmentosa. Proc Natl Acad Sci U S A, 103(30), 11300-11305. doi:10.1073/pnas.0604056103
Liu, Y. J., Zhan, J., Liu, X. L., Wang, Y., Ji, J., & He, Q. Q. (2014). Dietary flavonoids intake and risk of type 2 diabetes: a meta-analysis of prospective cohort studies. Clin Nutr, 33(1), 59-63. doi:10.1016/j.clnu.2013.03.011
Maaliki, D., Shaito, A. A., Pintus, G., El-Yazbi, A., & Eid, A. H. (2019). Flavonoids in hypertension: a brief review of the underlying mechanisms. Curr Opin Pharmacol, 45, 57-65. doi:10.1016/j.coph.2019.04.014
Miesfeld, J. B., & Brown, N. L. (2019). Eye organogenesis: A hierarchical view of ocular development. Curr Top Dev Biol, 132, 351-393. doi:10.1016/bs.ctdb.2018.12.008
Miranda, M., Arnal, E., Ahuja, S., Alvarez-Nolting, R., Lopez-Pedrajas, R., Ekstrom, P., . . . Romero, F. J. (2010). Antioxidants rescue photoreceptors in rd1 mice: Relationship with thiol metabolism. Free Radic Biol Med, 48(2), 216-222. doi:10.1016/j.freeradbiomed.2009.10.042
Piano, I., D’Antongiovanni, V., Testai, L., Calderone, V., & Gargini, C. (2019). A Nutraceutical Strategy to Slowing Down the Progression of Cone Death in an Animal Model of Retinitis Pigmentosa. Front Neurosci, 13, 461. doi:10.3389/fnins.2019.00461
Russo, G. L., & Ungaro, P. (2019). Chapter 9 – Epigenetic Mechanisms of Quercetin and Other Flavonoids in Cancer Therapy and Prevention. In A. Bishayee & D. Bhatia (Eds.), Epigenetics of Cancer Prevention (Vol. 8, pp. 187-202): Academic Press.
Shen, J., Yang, X., Dong, A., Petters, R. M., Peng, Y.-W., Wong, F., & Campochiaro, P. A. (2005). Oxidative damage is a potential cause of cone cell death in retinitis pigmentosa. 203(3), 457-464. doi:10.1002/jcp.20346
Simonian, N. A., & Coyle, J. T. (1996). Oxidative stress in neurodegenerative diseases. Annu Rev Pharmacol Toxicol, 36, 83-106. doi:10.1146/annurev.pa.36.040196.000503
Storz, G., & Imlay, J. A. (1999). Oxidative stress. Curr Opin Microbiol, 2(2), 188-194.
Tremblay, F., Waterhouse, J., Nason, J., & Kalt, W. (2013). Prophylactic neuroprotection by blueberry-enriched diet in a rat model of light-induced retinopathy. J Nutr Biochem, 24(4), 647-655. doi:10.1016/j.jnutbio.2012.03.011
Uttara, B., Singh, A. V., Zamboni, P., & Mahajan, R. T. (2009). Oxidative stress and neurodegenerative diseases: a review of upstream and downstream antioxidant therapeutic options. Curr Neuropharmacol, 7(1), 65-74. doi:10.2174/157015909787602823
Varshney, R., Mishra, R., Das, N., Sircar, D., & Roy, P. (2019). A comparative analysis of various flavonoids in the regulation of obesity and diabetes: An in vitro and in vivo study. Journal of Functional Foods, 59, 194-205. doi:https://doi.org/10.1016/j.jff.2019.05.004
Verbakel, S. K., van Huet, R. A. C., Boon, C. J. F., den Hollander, A. I., Collin, R. W. J., Klaver, C. C. W., . . . Klevering, B. J. (2018). Non-syndromic retinitis pigmentosa. Prog Retin Eye Res, 66, 157-186. doi:10.1016/j.preteyeres.2018.03.005
Zhao, J., Zhu, M., Kumar, M., Ngo, F. Y., Li, Y., Lao, L., & Rong, J. (2019). A Pharmacological Appraisal of Neuroprotective and Neurorestorative Flavonoids Against Neurodegenerative Diseases. CNS Neurol Disord Drug Targets, 18(2), 103-114. doi:10.2174/1871527317666181105093834



