Matriz Extracelular: Arquitetura Dinâmica da Vida Celular e Suas Implicações em Doenças do Sistema Nervoso
Bruno Gaidargi, Victor Ricardo Cândido Torres da Silva, Tabata Bustos, Heloísa Belem, Marcela Bermúdez Echeverry
Ilustração: Débora Sterzeck Cardoso
Laboratório de Neurofarmacologia do Sistema Motor / Centro de Matemática, Computação e Cognição / Universidade Federal do ABC
Em 1882, Camillo Golgi, um dos principais nomes da Neurociência, descobriu uma estrutura fundamental para o funcionamento celular. Anos mais tarde, Ramon y Cajal cometeu um de seus raros equívocos e considerou-a como um artefato, ou um mero resíduo sem um papel funcional significativo1. Estamos falando da Matriz Extracelular (MEC), uma rede de macromoléculas que preenchem o espaço extracelular e contribui para uma infinidade de processos biológicos, como a regulagem da adesão e da sinalização celular que auxilia no desenvolvimento de todos os tecidos2. Alvo de um crescente número de pesquisas, essa complexa rede vem demonstrando um potencial cada vez maior para a explicação e o entendimento de processos neurais e de diferentes tipos de neuropatologias4. Apesar de ser essencial para diferentes estruturas do nosso corpo, os cientistas recentemente começaram a focar no seu papel dentro do sistema nervoso e na importância do seu funcionamento em processos neuronais, como na plasticidade sináptica5,9, no sistema de memórias e traumas6, no neurodesenvolvimento7 e na relação direta com processos cognitivos superiores8.
Responsável por compor cerca de 40% do volume cerebral em desenvolvimento e 20% do cérebro adulto3, a MEC dentro do SNC é conhecida por desempenhar papeis estruturais e funcionais. Um conceito que vem ganhando cada vez mais destaque é a sinapse tetrapartite, que engloba tanto a matriz extracelular como as células da glia na fisiologia complexa de uma sinapse5,9. Além disso, a natureza tridimensional da MEC é responsável por garantir uma forma estrutural bem definida no ambiente celular. Sem ela, seríamos apenas uma massa amorfa de células2.
A MEC é composta principalmente de proteínas fibrosas, como o colágeno, que garante sua estrutura; por glicosaminoglicanos (GAGs), como os sulfatos de condroitina e o ácido hialurônico; e pelas proteínas de adesão15. No SNC, manipular essas estruturas pode resultar na recuperação de lesões medulares, na restauração da dominância ocular, na extinção de memórias de medo e na prevenção contra a recaída ao uso de drogas de abuso, por exemplo. Há três principais formas de manipular a MEC: pela intervenção genética, pelo controle das enzimas endógenas que degradam seus componentes e pela aplicação de um fármaco que desmembra a matriz16.
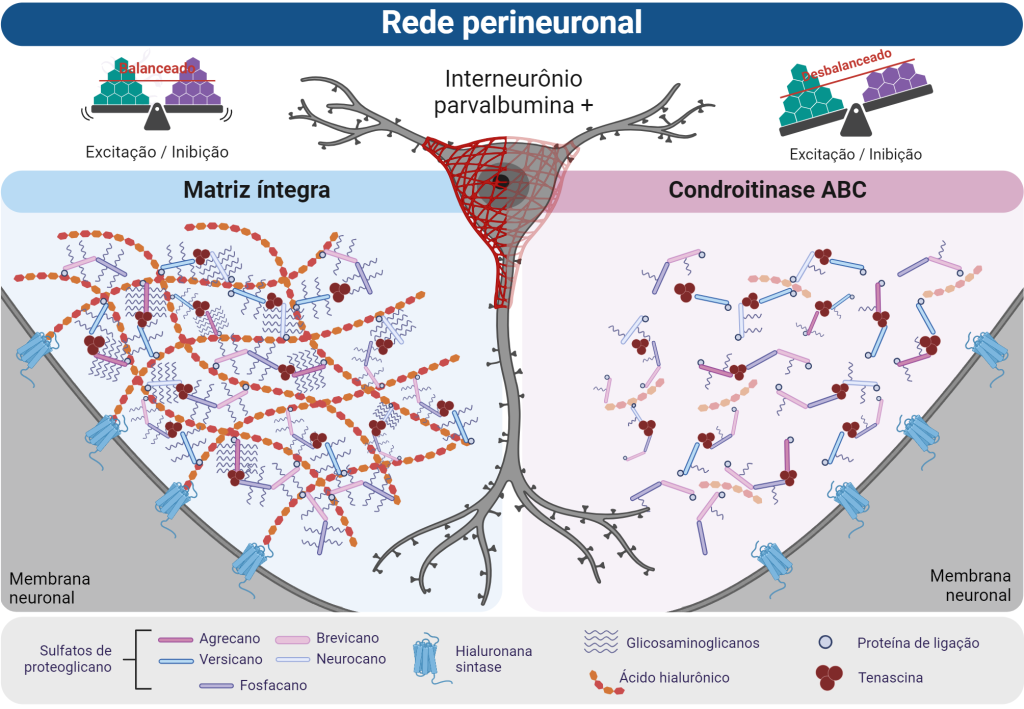
A composição da matriz do sistema nervoso central (SNC) muda dinamicamente durante o desenvolvimento e constitui diferentes compartimentos nas áreas do SNC, que atuam de formas distintas entre si. O primeiro deles é a membrana basal, que se desenvolve no período de angiogênese e se forma em paralelo com os vasos sanguíneos. Essa estrutura tem um papel crucial na formação e manutenção da barreira hematoencefálica (BHE). Ela conecta o compartimento de células endoteliais aos pés dos astrócitos, estruturando assim a BHE10. Num quadro de isquemia cerebral, a membrana basal se rompe, provavelmente pela atuação descontrolada de enzimas que clivam os componentes da matriz, expondo a BHE e os microvasos e promovendo hemorragia ou edema11. O segundo e talvez mais importante tipo de MEC são as redes perineuronais (RPNs). Essas redes são um tipo especializado de matriz altamente condensada que circunda sobretudo o soma de interneurônios gabaérgicos que expressam parvoalbumina, mas também são encontradas em volta de alguns neurônios piramidais5. Seu principal ponto de interesse é devido sua atuação direta no fino balanço excitatório/inibitório do SNC, cujo comprometimento está associado à maioria das neuro e psicopatologias. As RPNs são detectadas pela primeira vez relativamente tarde no desenvolvimento, durante períodos críticos de maturação sináptica, atuando para o fechamento desse período e consolidando um circuito sináptico. Acredita-se que essas redes também atuem na estabilização sináptica, neuroproteção e no tamponamento iônico12. Alterações críticas nas RPNs no SNC adulto podem causar um nível aberrante de sinapses, podendo levar a um quadro epiléptico13. Além disso, diferentes estudos têm mostrado como as RPNs estão envolvidas no contexto de abuso pelo uso de substâncias. Um estudo feito por Xue e colaboradores14 demonstrou que aplicar a enzima condroitinase ABC (ChABC), que digere os principais componentes da MEC, para degradar as RPNs na amígdala de roedores antes do processo de extinção do uso de drogas atenuou a reintegração – ou recaída – posterior. O tratamento com ChABC resultou em níveis mais elevados de proteína de BDNF (fator neurotrófico derivado do cérebro), GluR1 e GluR2 (receptores glutamatérgicos) na amígdala após a extinção do comportamento de uso abusivo de morfina, sugerindo um papel da MEC para a regulação dessas proteínas na consolidação da memória de extinção.
O terceiro tipo de MEC é a Matriz Perissináptica Difusa (ou Matriz Intersticial), que compõe a maior parte da MEC no SNC e atua circundando sinapses e participando da sinaptogênese e da plasticidade. Seus componentes são frequentemente modulados pelas metaloproteinases de matriz (MMPs), enzimas endógenas normalmente secretadas pela microglia que atuam de forma dependente de experiência para mudar a conformação da MEC4,15.
Estudos vêm demonstrando o importante papel da MEC em diversas patologias e transtornos do sistema nervoso, como depressão, esquizofrenia, transtorno bipolar, isquemia, esclerose lateral amiotrófica, transtorno do espectro autista, epilepsia, condições como hipóxia e uma série de outros problemas4. No cérebro, a MEC desempenha um papel crucial na neurodegeneração, com o comprometimento levando à perda sináptica e neuronal em vários distúrbios. Em doenças como Alzheimer e Parkinson, a MEC está associada influenciando a expressão gênica, a remodelação de proteínas e glicoproteínas, e a interação celular, contribuindo para a disfunção sináptica e neuronal17.
Na doença de Alzheimer, a MEC está envolvida na geração e degradação de placas de amiloide-β, produção de proteína Tau, resposta ao estresse oxidativo e resposta inflamatória18. Já na doença de Parkinson, proteínas como colágenos, fibronectina e tenascinas são diferencialmente expressas19. Alterações na expressão de genes associados à MEC são observadas em várias outras doenças neurodegenerativas, uma vez que também desempenha um papel crucial na neuroproteção e na plasticidade neural através da formação de redes perineuronais (PNNs)20.
Alterações nos proteoglicanos de sulfato de condroitina (CSPGs) após lesões neurais, como na esclerose múltipla e lesão da medula espinhal, podem inibir a reparação da mielina10. O fator de transcrição HIF-1, induzido em resposta à hipóxia, regula a expressão de genes da MEC, sugerindo que a hipóxia pode contribuir para a remodelação da MEC em condições de doença. A microglia pode modular as RPNs tanto em estados saudáveis quanto doentes, influenciando a regulação da MEC através das enzimas, sobretudo metaloproteinases, que modelam a estrutura da matriz4.
Os estudos sobre o uso da ChABC na recuperação de lesões na medula espinhal têm mostrado resultados promissores em modelos animais, especialmente em ratos. Um estudo sistemático e meta-análise indicou que a terapia com ChABC resultou em uma melhora significativa na função locomotora em ratos com lesão na medula espinhal, observada a partir de 7 dias após o tratamento e mantida por até 28 dias21. Outro estudo demonstrou que o tratamento com ChABC promoveu a regeneração de projeções sensoriais ascendentes e axônios do trato corticoespinal descendente, além de restaurar a atividade pós-sináptica abaixo da lesão, promovendo a recuperação funcional de comportamentos locomotores e proprioceptivos22.
Vemos então que a MEC desempenha um papel crucial na regulação de diversos processos celulares, tornando-se destaque em pesquisas neurobiológicas e farmacológicas. No entanto, a replicação precisa das condições da MEC in vitro apresenta várias limitações que podem impactar a validade dos estudos e aplicações terapêuticas. Modelos in vitro incluem a dificuldade em replicar a complexidade estrutural e bioquímica do ambiente nativo, a falta de propriedades dinâmicas e a incapacidade de vascularização adequada23. Portanto, o uso de modelos animais continua sendo a melhor via para esse tipo de estudo.
A manipulação da MEC, por meio de intervenções genéticas ou farmacológicas, oferece um caminho promissor para a regeneração de tecidos nervosos e a modulação de memórias e comportamentos. No campo da neurofarmacologia, a MEC se destaca como um alvo terapêutico crucial, abrindo novas possibilidades para o tratamento de doenças neurodegenerativas e lesões neurais. Além disso, buscar entender a complexidade de seu dinamismo pode elucidar a respeito de diversos processos estruturais e fisiológicos do SNC.
REFERÊNCIAS
- Celio, M. R., Spreafico, R., De Biasi, S., & Vitellaro-Zuccarello, L. (1998). Perineuronal nets: past and present. Trends in neurosciences, 21(12), 510-515.
- Walma, D. A. C., & Yamada, K. M. (2020). The extracellular matrix in development. Development, 147(10), dev175596.
- Syková, E., & Nicholson, C. (2008). Diffusion in brain extracellular space. Physiological reviews, 88(4), 1277-1340.
- Soles, A., Selimovic, A., Sbrocco, K., Ghannoum, F., Hamel, K., Moncada, E. L., … & Cvetanovic, M. (2023). Extracellular matrix regulation in physiology and in brain disease. International journal of molecular sciences, 24(8), 7049.
- Mulholland, P. J., Chandler, L. J., & Kalivas, P. W. (2016). Signals from the fourth dimension regulate drug relapse. Trends in neurosciences, 39(7), 472-485.
- Fawcett, J. W., Fyhn, M., Jendelova, P., Kwok, J. C., Ruzicka, J., & Sorg, B. A. (2022). The extracellular matrix and perineuronal nets in memory. Molecular Psychiatry, 27(8), 3192-3203.
- Walma, D. A. C., & Yamada, K. M. (2020). The extracellular matrix in development. Development, 147(10), dev175596.
- Burket, J. A., Webb, J. D., & Deutsch, S. I. (2021). Perineuronal nets and metal cation concentrations in the microenvironments of fast-spiking, parvalbumin-expressing GABAergic interneurons: relevance to neurodevelopment and neurodevelopmental disorders. Biomolecules, 11(8), 1235.
- Dityatev, A., & Rusakov, D. A. (2011). Molecular signals of plasticity at the tetrapartite synapse. Current opinion in neurobiology, 21(2), 353-359.
- Lau, L. W., Cua, R., Keough, M. B., Haylock-Jacobs, S., & Yong, V. W. (2013). Pathophysiology of the brain extracellular matrix: a new target for remyelination. Nature Reviews Neuroscience, 14(10), 722-729.
- Wang, C. X., & Shuaib, A. (2007). Critical role of microvasculature basal lamina in ischemic brain injury. Progress in neurobiology, 83(3), 140-148.
- Dityatev, A., & Schachner, M. (2003). Extracellular matrix molecules and synaptic plasticity. Nature Reviews Neuroscience, 4(6), 456-468.
- McRae, P. A., & Porter, B. E. (2012). The perineuronal net component of the extracellular matrix in plasticity and epilepsy. Neurochemistry international, 61(7), 963-972.
- Xue, Y. X., Xue, L. F., Liu, J. F., He, J., Deng, J. H., Sun, S. C., … & Lu, L. (2014). Depletion of perineuronal nets in the amygdala to enhance the erasure of drug memories. Journal of Neuroscience, 34(19), 6647-6658.
- Fawcett, J. W., Oohashi, T., & Pizzorusso, T. (2019). The roles of perineuronal nets and the perinodal extracellular matrix in neuronal function. Nature Reviews Neuroscience, 20(8), 451-465.
- Reichelt, A. C., Hare, D. J., Bussey, T. J., & Saksida, L. M. (2019). Perineuronal nets: plasticity, protection, and therapeutic potential. Trends in neurosciences, 42(7), 458-470.
- Pintér, P., & Alpár, A. (2022). The role of extracellular matrix in human neurodegenerative diseases. International journal of molecular sciences, 23(19), 11085.
- Sun, Y., Xu, S., Jiang, M., Liu, X., Yang, L., Bai, Z., & Yang, Q. (2021). Role of the extracellular matrix in Alzheimer’s disease. Frontiers in aging neuroscience, 13, 707466.
- Rike, W. A., & Stern, S. (2023). Proteins and transcriptional dysregulation of the brain extracellular matrix in Parkinson’s disease: a systematic review. International Journal of Molecular Sciences, 24(8), 7435.
- Downs, M., Zaia, J., & Sethi, M. K. (2023). Mass spectrometry methods for analysis of extracellular matrix components in neurological diseases. Mass Spectrometry Reviews, 42(5), 1848-1875.
- Zhang, Y. Y., Xue, R. R., Yao, M., Li, Z. Y., Hu, C. W., Dai, Y. X., … & Mo, W. (2024). A systematic review and meta-analysis of chondroitinase ABC promotes functional recovery in rat models of spinal cord injury. Nutritional Neuroscience, 27(9), 917-933.
- Bradbury, E. J., Moon, L. D., Popat, R. J., King, V. R., Bennett, G. S., Patel, P. N., … & McMahon, S. B. (2002). Chondroitinase ABC promotes functional recovery after spinal cord injury. Nature, 416(6881), 636-640.
- Nicolas, J., Magli, S., Rabbachin, L., Sampaolesi, S., Nicotra, F., & Russo, L. (2020). 3D extracellular matrix mimics: fundamental concepts and role of materials chemistry to influence stem cell fate. Biomacromolecules, 21(6), 1968-1994.



