Dopamina e o Sistema Motor: Desvendando Funções, Disfunções e Interações Neuroquímicas
Victor Ricardo Cândido Torres da Silva¹, Bruno Gaidargi¹, Tabata Bustos¹, Heloisa Belem¹, Marcela Bermudez Echeverry¹
¹ Laboratório de Neurofarmacologia do Sistema Motor
Centro de Matemática, Computação e Cognição / Universidade Federal do ABC
Você com certeza já ouviu falar sobre a Dopamina. Ela é um neurotransmissor muito conhecido, mas talvez da maneira errada. Hoje em dia, em uma simples pesquisa na internet, você consegue encontrar vários textos falando sobre “Jejuns de Dopamina” e de como ela está envolvida em comportamentos de vício e prazer. Existe uma infinidade de livros de auto-ajuda abordando esse tema, mas que tal explorarmos essa famigerada molécula do sistema nervoso de forma um pouco mais completa?
A dopamina tem muitas funções. Podemos citar sua participação no sistema de recompensa, nos processos que modulam a atenção (Talia N. Lerner, Ashley L. Holloway, 2021), em diversos mecanismos do sistema motor, além de estar presente em neuropatologias e transtornos bem conhecidas, como a Doença de Parkinson, a Esquizofrenia e o Transtorno de Déficit de Atenção com ou sem Hiperatividade (Berke, 2018; Klein et al., 2019).
Sabemos que a Dopamina é a molécula da moda, mas, apesar da sua pluralidade funcional, iremos focar na parte não muito conhecida, mas bem importante desse neurotransmissor: seus aspectos motores, que é o alvo de estudos realizados pelo grupo de pesquisa “Neurofarmacologia do Sistema Motor”.
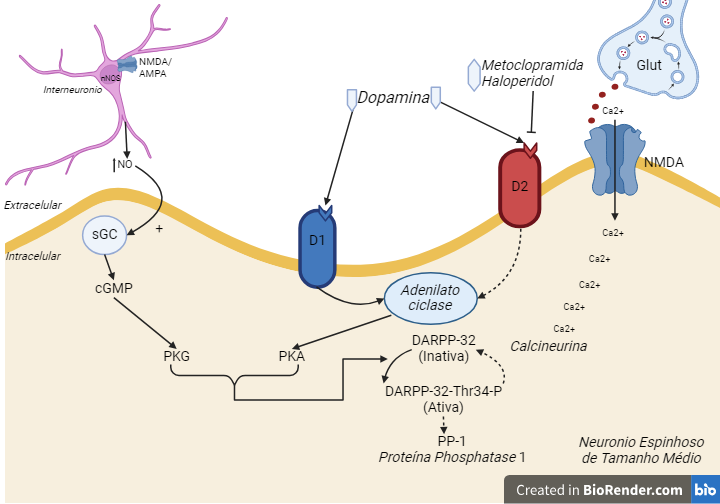
Nossos estudos vêm focando não somente na dopamina, mas também em outras moléculas e estruturas que interagem diretamente com ela para compor o processamento motor, localizado primordialmente nos núcleos (ou gânglios) da base. Dentre esses componentes estão o óxido nítrico, com os interneurônios nitrérgicos e a matriz extracelular. Além disso, temos os receptores dopaminérgicos, que são os verdadeiros responsáveis por orquestrar a integração e propagação dos sinais motores ao se ligarem ao neurotransmissor. Podemos entender a dopamina como uma espécie de chave que abre dois grupos de portas: um grupo de ativação celular (grupo D1) e um grupo de inativação celular (grupo D2) (Hong et al., 2021). Por exemplo, Doença de Parkinson (DP) pode cursar com polimorfismos dos receptores D2, levando a uma possível hipoatividade desse receptor.
Além disso, existem algumas classes de fármacos chamados antipsicóticos, que são usados para tratar a esquizofrenia. Eles atuam como bloqueadores dopaminérgicos do receptor D2 (D2R) e servem para tratar predominantemente os sintomas positivos da doença, como alucinações e delírios. No entanto, um efeito colateral indesejado desses agentes medicamentosos é conhecido como efeito parkinsonismo, que consiste na indução de sintomas motores semelhantes a aqueles da DP. Isso ocorre pois, enquanto a esquizofrenia caracteriza-se por uma possível hiperativação desses receptores, a DP está relacionada com a hipoativação. Ou seja, o remédio usado para tratar uma, acaba induzindo sintomas da outra. Tais sintomas motores causados pelos antipsicóticos são rotulados como “sintomas extrapiramidais” (EPS-Extrapyramidal Symptoms), que podem ser desenvolvidos por tratamento agudo ou crônico (Perkins, 2002). Dentre os sintomas, está a catalepsia, que é um sintoma acinético, ou seja, o paciente permanece imóvel numa posição, quase que perplexo, por um período longo.
Frente a essas condições associadas a um mal funcionamento dos receptores dopaminérgicos, é necessário haver um balanço fino entre ambas as ativações ou vias dopaminérgicas (via D1R e via D2R) (Figura 1), para um controle de movimento efetivo do paciente. Encontrar a harmonia ideal entre esse balanço pode ser uma tarefa difícil, uma vez que ao aplicar medicamentos que tratam uma doença acaba desencadeando sintomas de outra, como é o caso de antipsicóticos na esquizofrenia, ou da L-DOPA (levodopa) usada para a DP.
Os estudos do grupo de Neurofarmacologia do Sistema Motor buscam entender a relação dessas drogas que atuam no sistema motor, bem como os efeitos colaterais que elas causam, além da interação com outras estruturas e moléculas, como a Matriz Extracelular e o Óxido Nítrico, onde este pode produzir as chamadas “espécies reativas de oxigênio”, componentes neurotóxicos críticos para nossos neurônios, podendo resultar na morte neuronal (Sookram et al., 2011).
Com relação à matriz extracelular, pesquisas com DP em animais de experimentação tem mostrado que a micróglia, uma das células do Sistema Nervoso Central (SNC) envolvida na liberação de fatores de matriz, podem exibir um fenótipo quiescente ou ativado, esse último provavelmente liberando fatores pró-inflamatórios que podem ter efeitos deletérios nos neurônios. Numa região com perda de neurônios, como acontece na DP, entre outras neurodegenerativas, o fenótipo de micróglia ativada ou pró-inflamatória podem refletir na sobrevivência neuronal numa área lesada (Freitas et al., 2021). Quanto o NO pode participar nessa sobrevivência, seja como neurotransmissor ou produzindo estresse oxidativo, ainda é um motivo de pesquisa.
REFERÊNCIAS
Berke, J. (2018). What does dopamine mean? Is dopamine a signal for learning, for motivation, or both? Nature Neuroscience, 21(6), 787–793. https://doi.org/10.1038/s41593-018-0152-y.
Hong, S. I., Kang, S., Baker, M., & Choi, D. S. (2021). Astrocyte-neuron interaction in the dorsal striatum-pallidal circuits and alcohol-seeking behaviors. Neuropharmacology, 198(May), 108759. https://doi.org/10.1016/j.neuropharm.2021.108759
Klein, M. O., Battagello, D. S., Cardoso, A. R., Hauser, D. N., Bittencourt, J. C., & Correa, R. G. (2019). Dopamine: Functions, Signaling, and Association with Neurological Diseases. Cellular and Molecular Neurobiology, 39(1), 31–59. https://doi.org/10.1007/s10571-018-0632-3
Nishi, A., Watanabe, Y., Higashi, H., Tanaka, M., Nairn, A. C., & Greengard, P. (2005). Glutamate regulation of DARPP-32 phosphorylation neostriatal neurons involves activation of multiple signaling cascades. Proceedings of the National Academy of Sciences of the United States of America, 102(4), 1199–1204. https://doi.org/10.1073/pnas.0409138102
Perkins, D. O. (2002). Predictors of noncompliance in patients with schizophrenia. Journal of Clinical Psychiatry, 63(12), 1121–1128. https://doi.org/10.4088/JCP.v63n1206
Sookram, C., Tan, M., Daya, R., Heffernan, S., & Mishra, R. K. (2011). Curcumin prevents haloperidol-induced development of abnormal oro-facial movements: Possible implications of Bcl-XL in its mechanism of action. Synapse, 65(8), 788–794. https://doi.org/10.1002/syn.20905
Talia N. Lerner, Ashley L. Holloway, J. L. S. (2021). Dopamine, Updated: Reward Prediction Error and Beyond. Curr Opin Neurobiol, 67(1), 123–130. https://doi.org/10.1016/j.conb.2020.10.012
Ana Freitas, Miguel Aroso, António Barros, Miriam Fernández, Eduardo Conde-Sousa, Marina Leite, Eva Daniela Carvalho, Cristina C Ribeiro, Rita Ferreira, Ana Paula Pêgo, Rui Vitorino, Maria Gomez-Lazaro (2021). Characterization of the Striatal Extracellular Matrix in a Mouse Model of Parkinson’s Disease. Antioxidants (Basel),10(7):1095. DOI: 10.3390/antiox10071095



